Now Loading...

Now Loading...
骨は豊富なサイトカイや成長因子を含む細胞外基質(骨基質)と骨構成細胞(破骨細胞、骨芽細胞、骨細胞)からできています。骨の表面では、破骨細胞が古い骨を溶解し取り除き、骨芽細胞が新しい骨基質に置き換えられることで、その強靭さを保っています。この再構築は"骨リモデリング"と呼ばれ骨の動的な恒常的を保っています。しかし、どの様に破骨細胞が骨表面で分化誘導され、骨リモデリングを開始するのかは、これまで良く分かっていませんでした。
骨細胞は骨構成細胞の90%の数を占めるにもかかわらず、骨基質という特殊な硬組織環境に埋没し単離することが難しく、その細胞特性や機能について謎が多い細胞でした。我々は骨細胞の単離培養法を確立し、骨細胞が破骨細胞分化因子RANKLを強力に発現していること見出しました。さらに、骨細胞特異的なRANKL欠損マウスの作成から、骨細胞が破骨細胞を分化誘導し骨リモデリングの開始を司っていることを明らかにしました(Nat Med 2011;大学プレス, Nature Japan)。
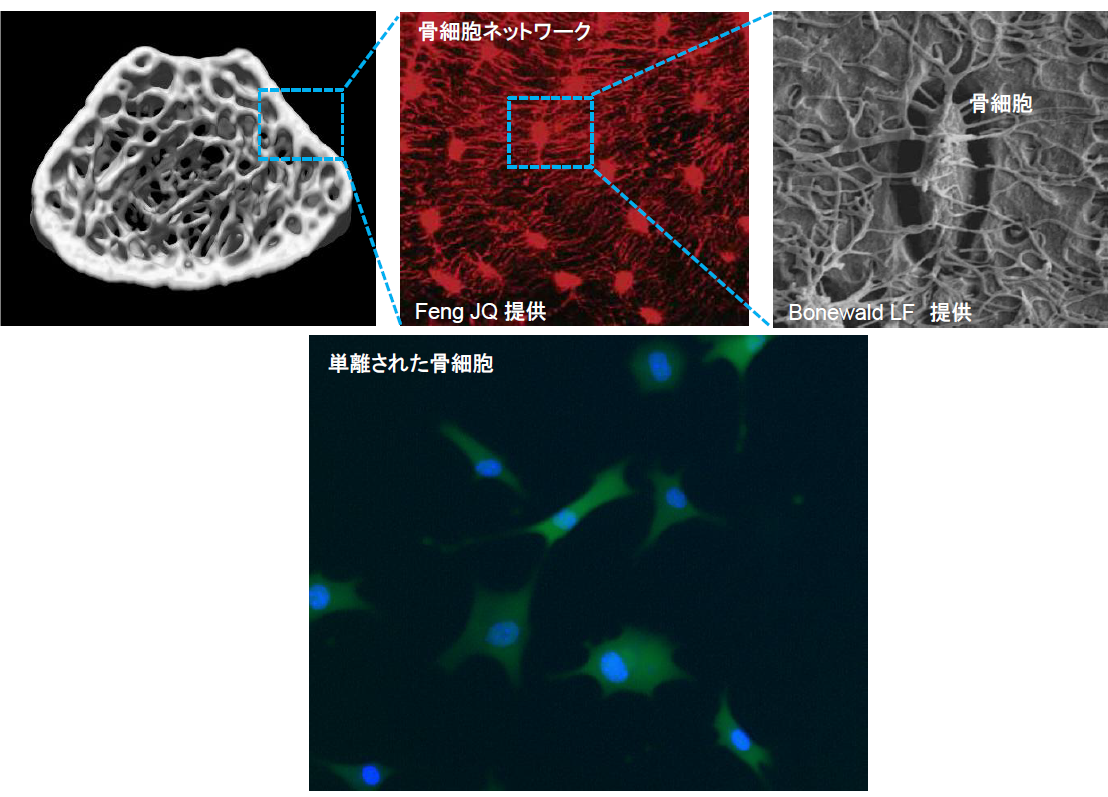
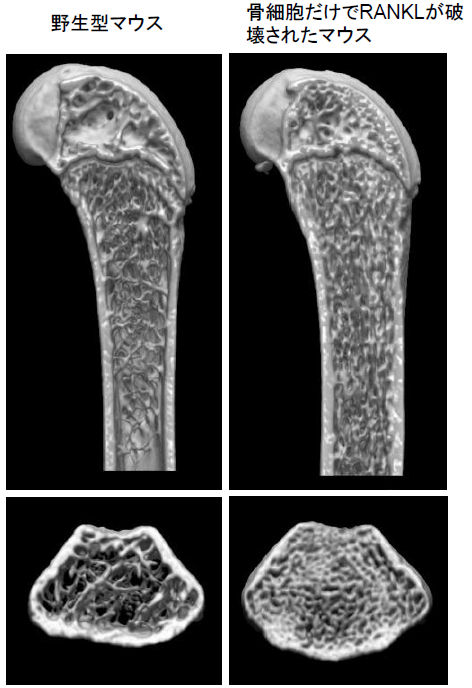
この知見は、骨細胞と破骨細胞の細胞間ネットワークによって骨リモデリングが制御されていることを生体レベルで実証した報告であり、これまでの骨代謝学の概念を一新する研究成果として、国内外で注目されています (論説記事:Nat Rev Endco, Nat Rev Rheumatol、朝日新聞など各社)。
さらに、我々は、骨生物学の研究領域に積極的に新たな研究手法を積極的に取り入れ、骨形成系細胞(骨細胞、骨芽細胞)を大量培養することで得られる培養上清から、破骨細胞の機能解析を展開し新規の骨保護分子Semaphorin3A(Sema3A)を同定しました(Nature 2012;JSTプレス)。
本分子は骨破壊を抑制し、骨形成を促進するこれまでに類をみない骨保護作用を有し、骨を丈夫にする分子であることが、遺伝子改変マウスの解析から明らかになり、骨再生や骨粗鬆症への治療効果も実証されています。この研究成果もまた、骨代謝学の発展と骨疾患制圧の足掛かりに成り得る業績として、国際的に注目されています(論説記事:Nature News and Views, Nat Rev Drug Dis, 朝日、読売新聞など)。
超高齢社会である我が国において、骨粗鬆症患者は推計1200万人を超え、予備軍を含めると2000万人と言われています。骨リモデリングのバランスが崩れ、骨吸収の速度が骨形成の速度を上回った場合に骨密度が低下し骨粗鬆症になってしまいます。骨粗鬆症は特に女性に多い病気で、閉経に伴い女性ホルモンのエストロゲンが低下することで発症すると考えられています。骨の密度と強度の低下は、結果的に大腿骨頸部や椎骨の骨折をきたし寝たきり状態などの原因となり、QOL(生活の質)を低下させ死亡率を高める大きな社会問題となっています。
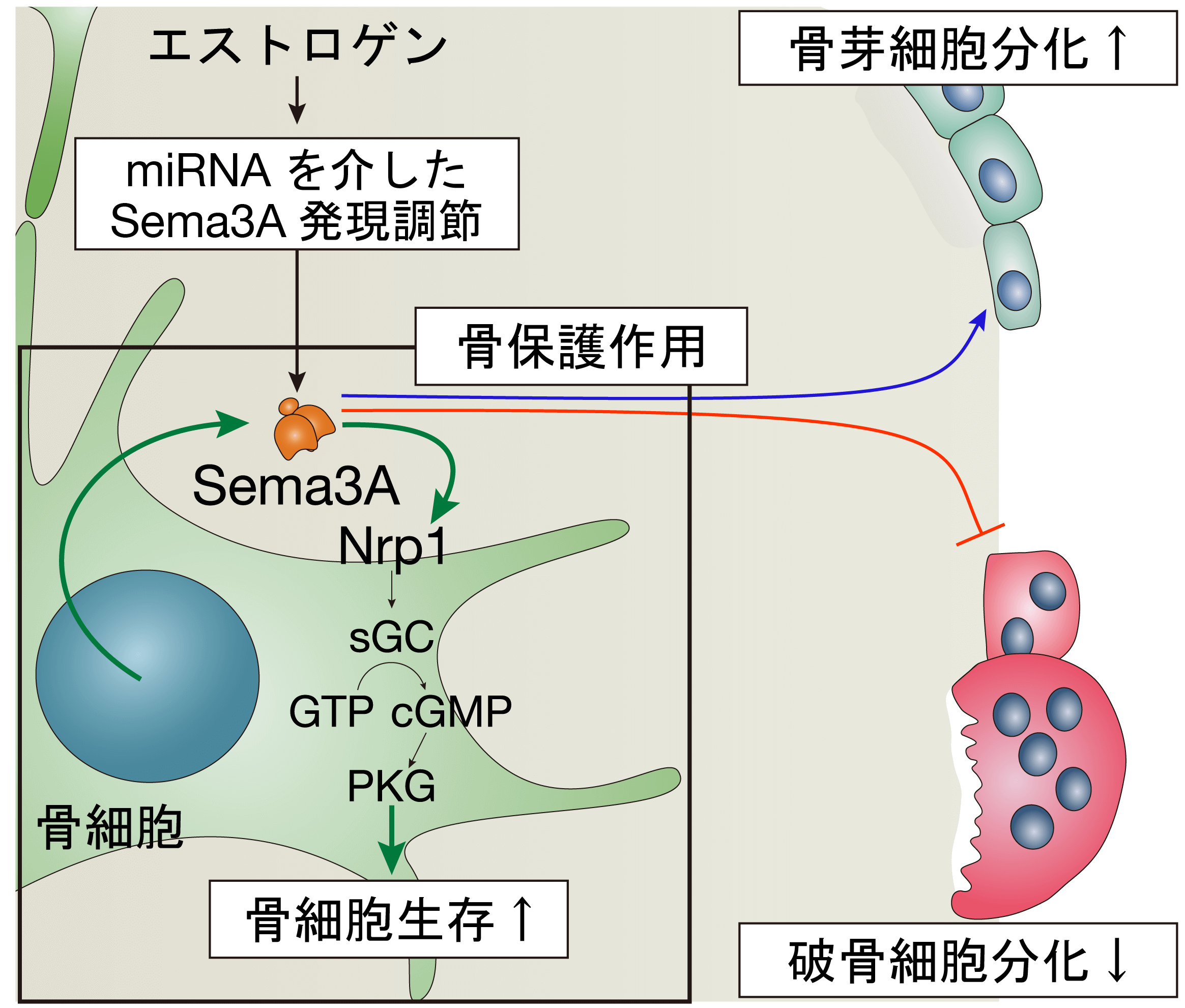
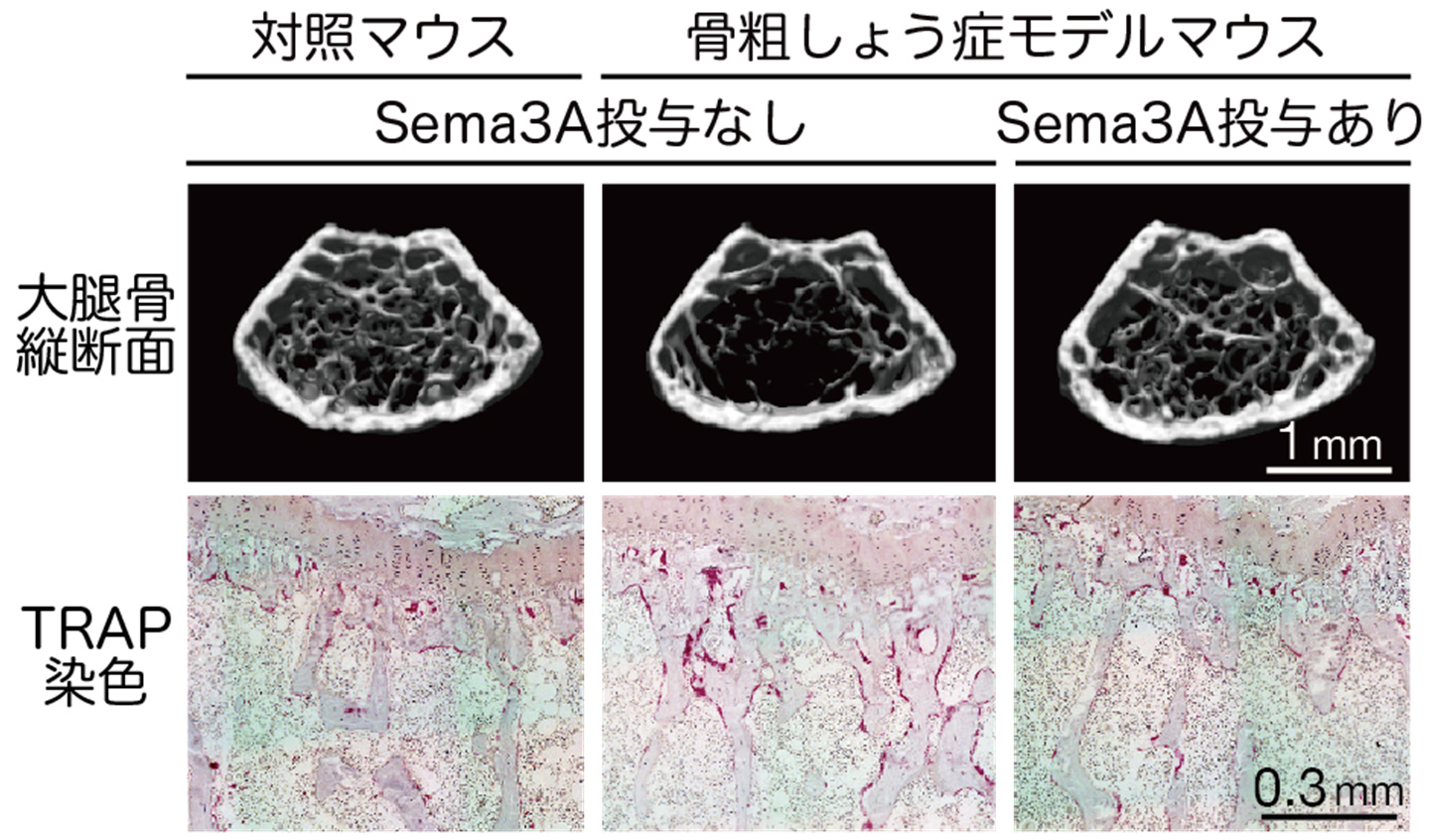
最近、我々はSema3Aがエストロゲンにより発現調整されていること、そして、骨細胞が発現するSema3Aが、骨細胞自身に作用して細胞の生存を維持していることを見出しました。また、閉経に伴い血中Sema3Aの量が低下することをヒト女性でも確認し、エストロゲン欠乏によって誘導される骨粗鬆症が、Sema3Aの低下による骨保護作用の破綻であることを明らかにしました。さらに骨細胞の生存シグナル経路の解析から、骨細胞の生存を調整するケミカルを同定し、生体レベルで骨を護る方法を確立しました(Cell Metab 2019:大学プレス)。本研究成果は、骨粗鬆症の早期診断マーカーの確立や革新的な骨疾患の治療戦略に繋がることが期待されます。
また、Sema3Aの発現は、老化に伴い低下することが見出されており、老化によってどのように制御されているのか今後の研究が重要と考えられます。老化に伴い骨量が減り強度が弱くなる一方で、骨内では顕著な脂肪髄になっていきます。骨芽細胞や脂肪細胞は、同一の間葉系細胞を由来とし分化することが知られていますが、その制御機構はあまり良く分かっていませんでした。我々は頭蓋冠由来の間葉系細胞を用いたトランスクリプトーム解析から、骨芽細胞への分化促進と脂肪細胞への分化抑制機能を持つ転写因子Mafを同定し、老齢マウスや遺伝子改変マウスの解析から、加齢に伴うMafの発現低下が骨芽細胞と脂肪細胞の運命を決定していることも明らかにしています(J Clin Invest 2010)。
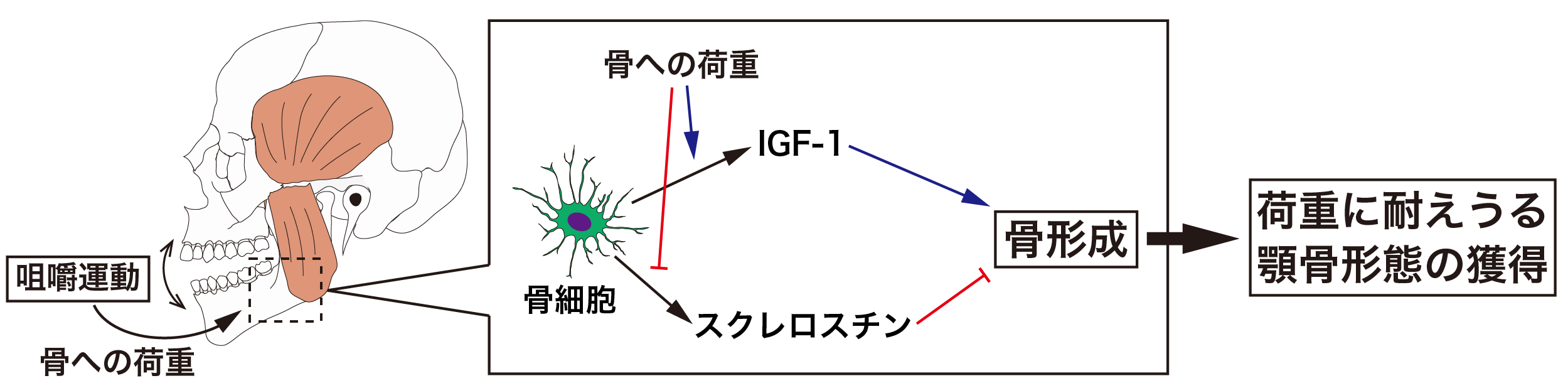
運動に伴うメカニカルストレスに応答し、骨はその組織量や強度を増加させます。一方、様々な疾患による寝たきりや宇宙空間など力学的負荷が少ない環境においては、速やかな骨量の減少と脆弱化を引き起こすことを、人類は経験的に認識していますが、その制御メカニズムはいまだ十分に理解されていません。骨構成細胞の大部分を占める骨細胞は、骨基質に埋め込まれた環境に位置し、細胞突起によって骨表面の破骨細胞や骨芽細胞とも密接にネットワークを形成していることから、外界からの力学的刺激やホルモンなど生理活性物質を感知し応答する骨の司令塔であると考えられています。
実際、我々は、新たな力学的免荷および負荷モデルを構築し骨解析を展開した結果、力学的負荷が少ないモデルでは骨粗鬆症を生じ、力学的負荷の強化モデルでは、骨が丈夫になることが確認されています(J Dent Res 2017, Sci Rep 2019)。さらに、この骨形成の増加には、これまで考えられていた骨形成抑制因子スクレロスチンの発現低下だけでなく、骨形成を促進するIgfの力学的負荷に伴う発現上昇が重要であることを見出されました(Sci Rep 2019:大学プレス)。
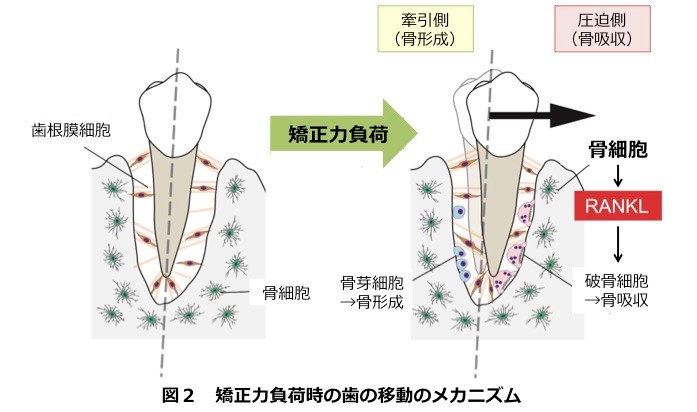
一方、歯科矯正の治療を成功させるためには、力学的負荷に伴い顎骨内で歯が移動するスペースを確保するため骨を破壊する破骨細胞の出現が必須です。しかしながら、メカニカルストレスがどのようなメカニズムで破骨細胞を出現させるかは解決していませんでした。
我々は、歯周組織の構成細胞の新規分画法を確立し、これまで想定さられていた歯根膜細胞や骨芽細胞と比べ、骨細胞がRANKLを強力に発現していることを見出しました。また、骨細胞特異的なRANKL欠損マウスで歯科矯正モデルを実施しても、歯の移動が抑制されることから、力学的負荷を骨細胞が感知しRANKLを応答分子として発現することで破骨細胞を出現させ、顎骨のリモデリングを司っていることを明らかにしました(Sci Rep 2017:大学プレス)。
骨細胞の細胞特性やその機能を明らかにすることは、骨研究を発展させる上で大きな意味を持ちます。現在、我々は骨細胞の全遺伝子解析や新規機能解析法をプラット・ホームとして、骨細胞の力学的刺激の感知・応答機構の解明する研究を展開しています。
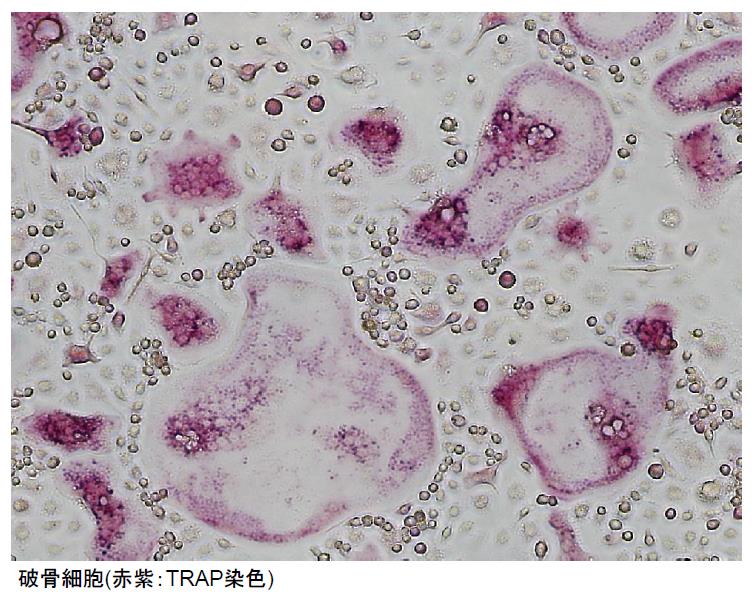
破骨細胞は、単球/マクロファージ系の前駆細胞を由来とし、RANKLの刺激を受け、細胞融合することで多核の巨細胞に分化誘導されます。破骨細胞は酸とプロテアーゼを分泌し、骨を溶解できる特殊な細胞であり、過剰な破骨細胞の活性化が生じ骨リモデリングのバランスが破綻すると、骨粗鬆症、関節リウマチや癌転移による骨破壊の病因になってしまいます。従って、破骨細胞の分化制御機構を理解することは、様々な骨疾患の治療戦略を確立する上で大きな意味を持ちます。実際、現在、骨粗鬆症の治療薬として汎用されるビスフォスフォネートや抗RANKL中和抗体などの薬剤は、破骨細胞を標的とし、人類の健康維持に大きく貢献しています。
2002年に破骨細胞分化におけるトランスクリプトーム解析からマスター転写因子NFATc1が同定され、RANK受容体からNFATc1へ至る分子情報伝達の研究が、グローバルレベルで活性化されてきました。我々は、RANK受容体の新規アダプター分子Gab2の発見(Nat Med 2005)や、シグナル活性化キナーゼCaMKIVの同定(Nat Med 2006)など、破骨細胞の分化を制御するシグナル経路を遺伝子欠損マウスで明らかにしました。また、破骨細胞分化の網羅的な遺伝子発現データベースから、破骨細胞分化を制御するITIM含有 NKレセプターLy49Qの同定(Biochem Biophys Res Commun 2010)や、破骨細胞のエピジェネティックな新規制御分子も発見しています(Biochem Biophys Res Commun 2014)。さらに、破骨細胞の異常な活性化は様々な病的骨破壊の病因となるため、破骨細胞の寿命を制御する分子を網羅的に解析し、遺伝子欠損マウスの解析から破骨細胞の生存に関与する遺伝子も見出しています(Biochem Biophys Res Commun 2011)。
関節リウマチや歯周病など炎症性骨破壊では、破骨細胞が中心的な役割を果たすことが知られています。その分化・活性化機構を解明する上で、どのような細胞がRANKLを発現し破骨細胞を支持しているかを明らかにすることが重要なテーマです。我々は、遺伝子欠損マウスの解析からRANKLの発現細胞の解明する研究にも参画しています(Nat Med 2014, Ann Rheum Dis 2015, Nat Commun 2018)。さらに、炎症性状態における破骨細胞の遺伝子プロファイリングから細胞を活性化するキナーゼを同定し、その阻害剤を用いて炎症性骨破壊を抑制する方法を確立しました(Mol Rheuma 2019)。これらの研究成果は、炎症性骨破壊の革新的な治療戦略に繋がることが期待されます。
破骨細胞は、単核の破骨前駆細胞が細胞融合により多核化し巨大な破骨細胞へと分化し、骨を破壊する機能を持ちます。そのため、マスター転写因子NFATc1が複雑な分化・機能発現ステージごとに、どの様な遺伝子を制御しているかは、破骨細胞のバイオロジーを理解する上で重要なテーマです。我々は、破骨細胞の分化過程の網羅的な遺伝子発現解析から、NFATc1が制御する破骨細胞分化の脱抑制転写因子Blimp1を発見し、生体レベルでその重要性を明らかしました(Proc Natl Acad Sci USA 2010)。現在、我々はトランスクリプトームやプロテオーム解析など最新の解析ディバイスを用いて、NFATc1が制御する新たな標的遺伝子の同定し、生体レベルで破骨細胞のNFATc1制御機構を明らかにする試みに精力的に取り組んでいます。
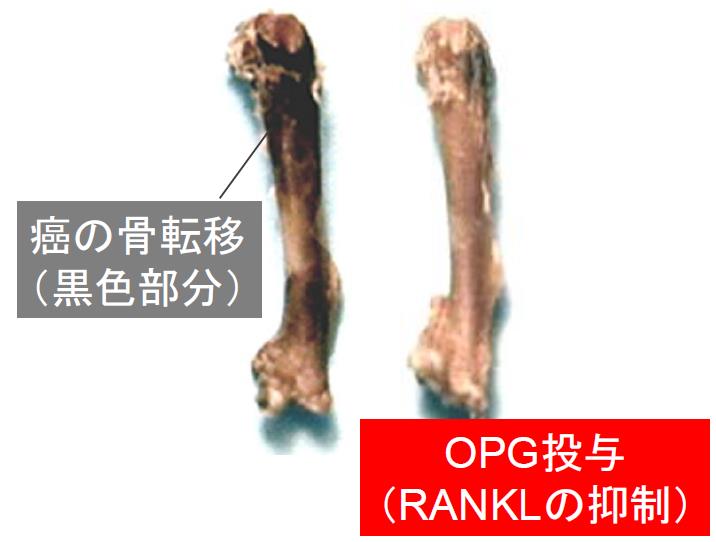
RANKLは、破骨細胞分化やリンパ節の形成に必須な分子として同定されましたが、現在では、免疫細胞の制御、乳腺の成熟や癌化、糖代謝の制御、さらには体温調節など、様々な生命システムにおいてに重要な役割を担うことが明らかになってきました(Trends Endocrinol Metab 2012)。我々は、TNFファミリーの膜型サイトカインとして細胞表面に発現するRANKLが、炎症性サイトカインによって可溶型へと変換されること、そして、その可溶化切断部位を明らかにしました(Biochem Biophys Res Commun 2000)。この報告は、関節リウマチ等の炎症性骨破壊における破骨細胞の活性化や延命、遊走能を制御する重要な知見です。さらに、我々は、乳癌患者における様々なホルモンやサイトカインの受容体の発現解析から、RANK受容体が乳癌患者の原発巣に強く発現することを見出し、骨に発現するRANKLが癌の骨転移を誘発することで癌転移を成立させることをモデルマウスで実証しました(Nature 2006)。この研究成果は、長年不明であった癌の骨転移メカニズムの解明した重要な取り組みです。2010年には欧米においてヒト抗RANKL中和抗体が、癌骨転移と骨粗鬆症の骨破壊抑制の治療薬剤として発売されました。我が国でも癌骨転移(2012年)、骨粗鬆症(2013年)、関節リウマチ(2017年)の骨破壊治療に適応認可されています。我々の研究成果は、本抗体治療法が癌の骨転移自体を抑制する未来治療に繋がるものとして期待されています (Nature Japan、朝日新聞など)。
また、RANKLの発現細胞や臓器は多岐にわたるため、様々な生命システムとその破綻による疾患発症に関与しています。難治性の自己免疫疾患である多発性硬化症では、病原性T細胞が発現するRANKLが、持続的な炎症を生じさせること (Immunity 2015)、さらに、RANKLが腸管免疫系の制御していること(Nat immunol 2017, Biochem Biophys Res Commun 2018)など、遺伝子欠損マウスを用いた研究にも我々は参画しています。
運動器の主な構成要素である骨と筋肉は、ヒト生体組織重量の大部分を占める臓器であり、動的な恒常性を維持しながら直立歩行と運動を可能とし、健康的な日常生活を営むことに貢献しています。超高齢社会を迎えた我が国では、骨粗鬆症に伴う骨折、関節疾患やサルコペニアなど運動能力の低下や破綻状態が自立した生活を障害し、その後の生命予後を決定する大きな社会問題になっています。そして、統合的な運動機能を実現する骨と筋肉は、動物としての身体的な自立運動を実現するに留まらず、全身性の生命システムを制御し、その破綻から様々な疾患への関与が、現在、解明されつつあります。
骨と筋肉はこれまで、様々な臓器や細胞が産生するホルモンやサイトカインなどの因子により、制御される受動的な臓器であると考えられてきました。しかし、近年、筋肉の産生分子マイオカインや骨の産生分子オステオカルシンが、全身のエネルギー代謝に関与し糖尿病や肥満などに関与したり、腎臓や腸管に作用し全身のミネラル代謝を制御すること、さらには摂食や高次脳機能にも直接作用することも明らかにされてきました。従って、骨と筋肉を運動器の一部として考えるだけでなく、遠隔制御因子の産生臓器と位置づけ、生命システムの連環機構において能動的な役割を担っていることを理解する取り組みが、今後、益々、重要になってくると考えられます。
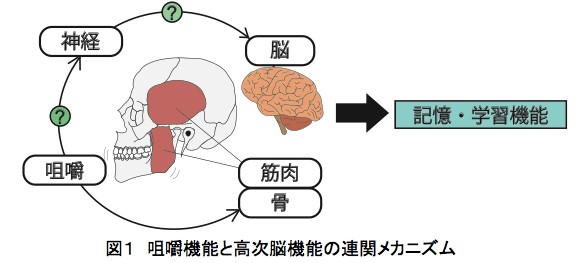
超高齢化社会の進行に伴い、寝たきりなど運動機能の低下した患者や加齢に伴い歯を失い咀嚼機能が低下した高齢者では、認知症のリスクが高まることが分かってきました。我々は、マウスで咀嚼運動の刺激を低下させるモデルを構築し、顎骨量や咀嚼筋の低下が記憶・学習機能を障害することを見出しました。さらに、記憶・学習を司る脳領域である海馬の解析から、咀嚼刺激の低下が神経活動やシナプス形成、脳由来神経栄養因子の発現を低下させ、神経細胞が減少することを明らかにしました(J Dent Res 2017:大学プレス)。本研究の成果は、記憶・学習機能障害や認知症の予防において咀嚼運動の機能維持または強化が有効であることを示唆しています。将来、全身運動や咀嚼機能と脳機能を結びつけるメカニズムがさらに詳細に解明されることによって、記憶・学習機能障害の新たな治療法や予防法の分子基盤の確立に繋がることが期待されます。
現在、我々は、運動器を構成する骨や筋肉のトランスクリプトームやプロテオーム解析から、多臓器を連環制御する新たな分子の同定に取り組み、運動器を基軸とした生命システムの解明を試みています。